毒死蜱对鱼类的毒性研究进展
nobonita deb1和如此Das.1*
1生命科学与生物信息系,萨姆斯大学,Silchar,788 011印度。
DOI:http://dx.doi.org/10.12944/CWE.8.1.17
抽象的
毒死蜱(Chlorpyrifos, CPF)是一种广谱有机磷杀虫剂,用于害虫防治已超过十年。它是第二大销售OP,被发现对鱼的毒性比有机氯化合物更大。CPF通过空气漂流或地表径流进入自然水域,在水中生活的不同生物中积累,特别是鱼类,从而使其容易受到几个突出的影响。众所周知,低剂量CPF可抑制乙酰胆碱酯酶,引起行为、神经、氧化、组织病理学、内分泌和其他影响。本文综述了CPF在鱼类中的各种作用。
关键词
论坛;人事处;鱼;有毒
复制以下内容以引用本文:
DED N,DAS S.紫杉虾在鱼类中的毒性:审查。Curr World Environ 2013; 8(1)DOI:http://dx.doi.org/10.12944/CWE.8.1.17
复制以下内容以引用此URL:
DED N,DAS S.紫杉虾在鱼类中的毒性:审查。Curr World Environ 2013; 8(1)。可从://www.a-i-l-s-a.com/?p=3107
文章出版历史
| 已收到: | 2013-01-24 |
|---|---|
| 公认: | 2013-02-14 |
介绍
氯吡啶(O,O-二乙基-3,5,6-6-三氯-2-吡啶基硫亚甲酯; CPF)是一种广谱有机磷酸酯(OP),可商购用于控制影响农作物的叶面昆虫1和地下白蚁2CPF,自1965年首次被引入市场,已被全球使用作为一种杀虫剂,以控制农业和家庭的害虫。它是第二大销售OP,被发现对鱼的毒性比有机氯化合物更大。3.早些时候的报告显示,与毒死蜱有关的鱼类死亡事件在水中达到了数亿分之一。4.CPF在低碱度土壤中的平均半衰期为30天,2个月。它也可以在室内持续几周到几个月。5.CPF通过气流或地表径流进入周围水域,在不同的水生生物特别是鱼类体内积累,对它们产生不利影响。6.已知该OP杀虫剂抑制乙酰胆碱酯酶,其在通过快速水解神经递质乙酰胆碱至胆碱和乙酸酯中对胆碱能突触的神经递质起着重要作用。7.CPF杀虫剂的抑制作用取决于其与酶活性位点的结合能力,以及与行为和年龄相关的磷酸化速率8,9.并广泛应用于农药毒性的快速检测和预警。10据报道,它通过接触、摄入和蒸汽作用被激活,导致痉挛和瘫痪。CPF可通过吸入含有CPF的空气、摄入受污染的食物或皮肤接触CPF进入人体。它可引起急性中毒,众所周知的症状包括肌病、排尿增多、腹泻、出汗、流泪和流涎。11据报道,它还涉及多种机制,如导致肝功能障碍,12遗传毒性,13神经兽性和神经化素的变化。14CPF中毒可导致还原型谷胱甘肽(GSH)、过氧化氢酶(CAT)和谷胱甘肽s -转移酶(GST)活性显著下降。15尽管美国环境保护署(USEPA)自2000年以来已经停止了室内住宅杀虫剂的使用,CPF仍然是最广泛使用的杀虫剂之一,在美国,每年有超过800万磅的CPF用于农业用途。16、17在中国,CPF作为甲胺磷和对硫磷的替代品在农业中也被广泛使用,并已成为农产品中检测到的主要农药之一。18,19由于对果园和行作物的农业使用持续存在,CPF经常在空气、食物和水中被发现。尽管存在各种标准来尽量减少其在食物和水中的暴露,CPF经常被使用,在某些情况下会生物累积。6,20
鱼类可能是农药过度暴露最重要的非目标受害者,因为它们在食物链中发挥着重要作用。因此,本研究旨在综述农药毒死蜱对鱼类可能产生的不良影响的现有文献。
毒死蜱的结构
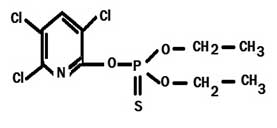
普通的名字
CPF也以其商品名Dursban和Lorsban而闻名
急性毒性
96 H LC.50蓝鳃太阳鱼技术级CPF的价值观,Lepomis macrochirus,是3.3 ppb,在虹鳟鱼中,雄鱼mykiss是3ppb,对于斑点叉尾鮰,ictalurus punctatus.是13.4 ppb。96 H LC.50为97.0%的CPF(活性成分,a.i.),Salvelinus湖红点鲑pH 6.0时为140ppb, pH 7.5时为98 ppb, pH 9.0时为205 ppb。Salmo Clarki,pH 7.5 96 h LC50在pH9.9时是18.4,它是5.4 ppb。96 H LC.50值为99.9% CPF (a.i.),Pimephales promelas是203ppb,而96 h LC5099.0%CPF(a.i)的值,以金色光泽表示,Notemigonus crysoleucas.是35磅。2196 H LC50少年和成人CPF的价值oreochromis niloticus为98.67µgL-1和154.01μg1.-1分别显示CPF可以评定为对鱼类的高毒性。2296 H LC50中央公积金对香港的价值P. oecila. reticulata.被发现为0.176 ppm / l。23信用证50用蚊鱼浸泡96小时,坎亲近种被发现是297mg / l24和LC.50常见鲤鱼中氯吡啶的值被发现为580μg/升。25此外,在CPF毒性应激期间,可以观察到一些行为异常,如吞咽、眼球运动增加、不规则游泳和随后的嗜睡。23
发展效应
各种研究表明,在发育过程中接触CPF会导致持续的神经行为功能障碍,即使是低剂量的CPF也不会引起急性毒性。斑马鱼在发育早期暴露CPF会导致长期的神经行为缺陷。研究了CPF对斑马鱼幼仔游泳行为的影响。26结果显示,这种持续的行为障碍会一直持续到成年。这种早期行为效应可以用来帮助确定CPF的哪些关键分子机制是行为损伤的基础。26Zebrafish,具有清晰的绒毛膜和广泛的发展信息基础,提供了评估毒物撞击神经发育的分子过程的优秀模型。26最近,发现斑马鱼的胚胎暴露于CPF导致歧视学习和游泳速度的显着损害27本研究结果表明,在斑马鱼受精后0 ~ 7天给予1µM CPF亚慢性剂量对体形态有显著影响。28结果还表明,即使是极低的亚慢性剂量CPF也会引起特定的行为缺陷或形态畸形。
神经毒性的影响
CPF可产生神经毒性作用。一些研究评估了在哺乳动物模型中急性或慢性暴露于CPF后的认知改变29、30但在鱼类领域,可用的数据很少。CPF可导致斑马鱼持续的神经行为损伤,我们对早期CPF暴露后的成年斑马鱼进行了感觉运动反应(轻拍惊吓反应和习惯化)、应激反应(新型坦克潜水试验)和学习(3室坦克空间辨别)测试。研究表明,CPF可引起斑马鱼选择性的长期神经行为改变。31另一项研究发现,暴露于CPF后,斑马鱼的全脑活动显著下降。32
疼痛活动
目前关于CPF对水生物种乙酰胆碱酯酶活性的毒性报道主要集中在急性毒性,但关于该农药对水生物种乙酰胆碱酯酶活性的亚慢性毒性报道较少。CPF是众所周知的乙酰胆碱酯酶抑制剂。33大量接触有机磷农药的症状包括肌肉抽搐、多动、瘫痪、失去平衡,最终死亡34虽然低级曝光涉及各种行为和生理障碍。34乙酰胆碱酯酶(AChE)和羧酸酯酶(CbE)已被用作农药的特异性生物标志物。24,35鱼类疼痛主要是胆碱能,其活性对于正常行为和肌肉功能至关重要。36CPF的急性全身毒性是通过活性代谢物毒死蜱oxon抑制胆碱酯酶引起的,毒死蜱对未成熟动物的毒性更大,尽管它们能够迅速从胆碱酯酶抑制中恢复。毒死蜱本身,而不是人们所说的毒死蜱oxon,直接针对的是发育中的大脑所特有的事件,而不一定与胆碱酯酶抑制有关。乙酰胆碱酯酶对斑马鱼神经系统的正常发育至关重要,37因此,对CPF等乙酰胆碱酯酶抑制剂的神经兽性畸形的斑马鱼研究特别相关。CPF是鱼峡鲶鱼中疼痛活动的有效抑制剂。38在与坎亲近种暴露于致死浓度的CPF 96小时后,观察到乙酰胆碱酯酶活性受到抑制。24乙酰胆碱的抑制导致乙酰胆碱在突触连接处积聚,可能改变了暴露鱼的运动行为。乙酰胆碱酯酶活性的恢复模式与运动行为之间存在正相关。目前的研究结果清楚地表明,被试生物的运动行为在生态毒理学中是一个有前途的工具,可以评估被试生物在不良反应后的恢复状态。在一个研究中Poecila网状,鱼脑AChE呈剂量依赖性抑制。高浓度CPF对乙酰胆碱酯酶的抑制高达66%。23
同样,CbE广泛分布于生物体内,其生理作用尚不清楚,但可能与脂质代谢和甾体生成有关。39一些被发现能抑制乙酰胆碱酯酶活性的环境污染物也可能抑制CbE活性40-42结果表明,蚊鱼肌肉ChE对毒死蜱的敏感性高于脑。在对鲤鱼的研究中,CbE活性表现出剂量-反应关系,随CPF的增加而降低。CPF对鲤鱼的影响提示低剂量CPF对经过一段时间后恢复的鱼的毒性作用和高剂量CPF对不易恢复的鱼的毒性作用,但相关机制有待进一步研究。43
行为毒性
行为也被认为是生态毒理学行为的一个有前途的工具44是内源性和外源性过程的综合结果,并且在各种行为和生理障碍中涉及低水平的暴露。34在斑马鱼的研究中,观察到发育CPF暴露后持续存在的行为功能障碍。31日,26日在毒性研究中,鱼类的游泳行为经常被观察到是一种反应,因为运动活动的改变可以表明对神经系统的影响。在一项研究中Poecila试到CPF导致了积极行为的展览,水的迅速吞咽,高曲调运动和异常和畸形的游泳运动。在死亡前随着时间的时间逐渐强调鱼。它们是昏昏欲睡,并且在崩溃前在死亡时表现出瞬态过度活动。23
氧化应激
近十年来,农药诱导的氧化应激作为一种可能的毒性机制也成为毒理学研究的热点。45,46需要一个抗氧化防御系统(ADS)来保护生物分子免受活性氧(ROS)的有害影响。鱼类具有防御机制,以中和各种化学物质代谢产生的活性氧(ROS)的影响。这些包括各种抗氧化防御酶,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPOx)、谷胱甘肽S-转移酶(GST)和谷胱甘肽还原酶(GR)。据报道,低分子量抗氧化剂如谷胱甘肽(GSH)、抗坏血酸(维生素C)和维生素A也有助于氧自由基的猝灭。47没有被这种抗氧化防御系统中和的ROS会损害所有的生物分子。ROS最重要的靶点之一是膜脂过氧化(LPO)。因此,LPO估计也被成功地用于表示这些化学物质在水生动物中诱导的氧化应激。48,49.农药可能引起活性氧(ROS)的产生,从而导致氧化应激,说明ROS在农药中毒中的作用。50农药诱导的氧化应激作为一种可能的毒性机制,也是近十年来毒理学研究的热点。51,45鱼中的抗氧化剂可以用作暴露于水生污染物的生物标志物。52脂质过氧化(LPO)是农药毒性的分子机制之一。53在坎亲近种暴露于致死浓度的CPF 96 h,观察到脂质过氧化水平升高。24同一研究发现,暴露鱼中的抗氧化酶(SOD,CAT和GR)活性降低也可以有效地用于更好地评估水生环境生物的毒性毒性。治疗oreochromis niloticus毒死蜱导致GST活性增加。22对GST活性的诱导作用已在研究中观察到斑鳟属trutta后propiconazole曝光。54gst介导的偶联可能是解毒过氧化脂质分解产物的重要机制,当过氧化脂质分解产物大量出现时,会产生一些不良的生物学效应。55诱导的GST活性表明该酶在抗异虫诱导的脂质过氧化的毒性保护中的作用。GST活性升高可能反映更好地保护农药毒性的可能性。在普华宫,Poecila网状不同亚致死浓度CPF暴露96 h后,测定脑组织、肝脏和鳃组织的氧化应激诱导电位。MDA含量在所有组织中都被诱导,但在鳃中观察到最大的上升(CPF的153%)。在同一研究中,在抗氧化防御系统(ADS)中,CPF处理后的大脑和鳃中GSH水平均增加(分别为23%和21%)。与对照组相比,各处理组CAT、GST、GR和SOD水平波动较大。集体研究结果表明,鱼接触农药后,MDA和ADS随AChE活性的抑制而波动。
内分泌功能
毒死蜱可干扰类固醇激素的产生。CPF被怀疑是对鱼类生殖系统产生有害影响的触发器。在罗非鱼,oreochromis niloticus,CPF暴露降低血清雌激素和睾酮水平。雌二醇水平在暴露15天后下降60.45%,48.65%,5,0,15%,15ppb紫紫外索治疗后的56.93%。22皮质醇,一种皮质类固醇激素,被认为是所有脊椎动物稳态的重要生理学效应,通过其对代谢和免疫功能的影响。56皮质醇水平oreochromis niloticus毒死蜱处理10 PPB(59.97%)和15 PPB(39.41)均低于对照水平。22
基因毒性和致突变性
在过去,CPF的遗传毒性已经在各种试验中进行了研究,但结果是矛盾的。57岁的58由于在水生环境中存在遗传毒素的存在,因此敏感生物标志物的开发,用于检测水生生物中的遗传毒性作用。59据报道,据据报道是基因毒性鲤鱼毛虫。 60暴露于0.08 lg/l CPF引起生殖损害水蚤麦格纳。 61研究Channa punctatus.,观察到CPF由于DNA修复,CPF产生了彗星诱导形式的DNA单链中的DNA单链断裂的浓度增加,并且由于DNA修复,损伤的时间依赖性降低。62已经在暴露于不同浓度的CPF的鱼类组织中观察到DNA损伤的降低,尽管降低是非线性的,但是可能表明受损DNA的修复,受损细胞的损失,或两者。63暴露时间和DNA损伤之间的这种反比关系可能是由于污染物的毒性,这可能会在形成DNA损伤时扰乱酶促过程。64另一种可能的解释可以是在各种组织中的代谢酶如细胞色素P450的基因激活,其为持久性有机污染物提供防御机制。65
组织病理学变化
鱼肝和鳃的形态改变是有用的生物标志物,以表明在环境压力源或毒物上发生前接触。虽然肝脏是解毒的主要器官,但由于它们的亲脂性,CPF具有高鳃吸收率;这可能是这种农药暴露的鱼类敏感性的贡献因素。62异常肝细胞可干扰机体的正常代谢,从而诱发疾病甚至死亡。另一方面,鳃在鱼类的呼吸、渗透调节、酸碱平衡和含氮废物排泄方面极其重要,它们是动物与外部环境接触的第一个区域。因此,鳃的形态被认为是一种有用的环境监测指标。
在对普通鲤鱼的研究中,CPF改变了鳃和肝的结构。鲤鱼的肝脏组织揭示了不同程度的水化变性,真空溶液,脓分核,脂肪渗透,而常见的鲤鱼的鳃率呈现不同程度的上皮肥大,细胞,水肿,具有上皮分离的地下膜,一般性坏死和上皮脱落。66
结论
本文综述了CPF对鱼类影响的研究进展。所有工人都认为,这种杀虫剂在农业和家庭中的广泛使用会对鱼类等非目标生物产生不利影响。研究杀虫剂对鱼类的影响具有诊断意义,因为所得结果可用于预测人类可能的毒性机制。此外,鱼类已被证明是评估暴露于环境污染和相关生化变化的水生生态系统健康状况的有用实验模型。研究发现,急性接触CPF杀虫剂的主要毒性是胆碱能突触和神经肌肉连接处的乙酰胆碱酯酶抑制。此外,氧化应激、内分泌系统紊乱、行为、神经和发育毒性是CPF毒性在鱼类中的一些可能表现。
参考
氯吡啶(O,O-二乙基-3,5,6-6-三氯-2-吡啶基硫亚甲酯; CPF)是一种广谱有机磷酸酯(OP),可商购用于控制影响农作物的叶面昆虫1和地下白蚁2CPF,自1965年首次被引入市场,已被全球使用作为一种杀虫剂,以控制农业和家庭的害虫。它是第二大销售OP,被发现对鱼的毒性比有机氯化合物更大。3.早些时候的报告显示,与毒死蜱有关的鱼类死亡事件在水中达到了数亿分之一。4.CPF在低碱度土壤中的平均半衰期为30天,2个月。它也可以在室内持续几周到几个月。5.CPF通过气流或地表径流进入周围水域,在不同的水生生物特别是鱼类体内积累,对它们产生不利影响。6.已知该OP杀虫剂抑制乙酰胆碱酯酶,其在通过快速水解神经递质乙酰胆碱至胆碱和乙酸酯中对胆碱能突触的神经递质起着重要作用。7.CPF杀虫剂的抑制作用取决于其与酶活性位点的结合能力,以及与行为和年龄相关的磷酸化速率8,9.并广泛应用于农药毒性的快速检测和预警。10据报道,它通过接触、摄入和蒸汽作用被激活,导致痉挛和瘫痪。CPF可通过吸入含有CPF的空气、摄入受污染的食物或皮肤接触CPF进入人体。它可引起急性中毒,众所周知的症状包括肌病、排尿增多、腹泻、出汗、流泪和流涎。11据报道,它还涉及多种机制,如导致肝功能障碍,12遗传毒性,13神经兽性和神经化素的变化。14CPF中毒可导致还原型谷胱甘肽(GSH)、过氧化氢酶(CAT)和谷胱甘肽s -转移酶(GST)活性显著下降。15尽管美国环境保护署(USEPA)自2000年以来已经停止了室内住宅杀虫剂的使用,CPF仍然是最广泛使用的杀虫剂之一,在美国,每年有超过800万磅的CPF用于农业用途。16、17在中国,CPF作为甲胺磷和对硫磷的替代品在农业中也被广泛使用,并已成为农产品中检测到的主要农药之一。18,19由于对果园和行作物的农业使用持续存在,CPF经常在空气、食物和水中被发现。尽管存在各种标准来尽量减少其在食物和水中的暴露,CPF经常被使用,在某些情况下会生物累积。6,20
鱼类可能是农药过度暴露最重要的非目标受害者,因为它们在食物链中发挥着重要作用。因此,本研究旨在综述农药毒死蜱对鱼类可能产生的不良影响的现有文献。
毒死蜱的结构

普通的名字
CPF也以其商品名Dursban和Lorsban而闻名
急性毒性
96 H LC.50蓝鳃太阳鱼技术级CPF的价值观,Lepomis macrochirus,是3.3 ppb,在虹鳟鱼中,雄鱼mykiss是3ppb,对于斑点叉尾鮰,ictalurus punctatus.是13.4 ppb。96 H LC.50为97.0%的CPF(活性成分,a.i.),Salvelinus湖红点鲑pH 6.0时为140ppb, pH 7.5时为98 ppb, pH 9.0时为205 ppb。Salmo Clarki,pH 7.5 96 h LC50在pH9.9时是18.4,它是5.4 ppb。96 H LC.50值为99.9% CPF (a.i.),Pimephales promelas是203ppb,而96 h LC5099.0%CPF(a.i)的值,以金色光泽表示,Notemigonus crysoleucas.是35磅。2196 H LC50少年和成人CPF的价值oreochromis niloticus为98.67µgL-1和154.01μg1.-1分别显示CPF可以评定为对鱼类的高毒性。2296 H LC50中央公积金对香港的价值P. oecila. reticulata.被发现为0.176 ppm / l。23信用证50用蚊鱼浸泡96小时,坎亲近种被发现是297mg / l24和LC.50常见鲤鱼中氯吡啶的值被发现为580μg/升。25此外,在CPF毒性应激期间,可以观察到一些行为异常,如吞咽、眼球运动增加、不规则游泳和随后的嗜睡。23
发展效应
各种研究表明,在发育过程中接触CPF会导致持续的神经行为功能障碍,即使是低剂量的CPF也不会引起急性毒性。斑马鱼在发育早期暴露CPF会导致长期的神经行为缺陷。研究了CPF对斑马鱼幼仔游泳行为的影响。26结果显示,这种持续的行为障碍会一直持续到成年。这种早期行为效应可以用来帮助确定CPF的哪些关键分子机制是行为损伤的基础。26Zebrafish,具有清晰的绒毛膜和广泛的发展信息基础,提供了评估毒物撞击神经发育的分子过程的优秀模型。26最近,发现斑马鱼的胚胎暴露于CPF导致歧视学习和游泳速度的显着损害27本研究结果表明,在斑马鱼受精后0 ~ 7天给予1µM CPF亚慢性剂量对体形态有显著影响。28结果还表明,即使是极低的亚慢性剂量CPF也会引起特定的行为缺陷或形态畸形。
神经毒性的影响
CPF可产生神经毒性作用。一些研究评估了在哺乳动物模型中急性或慢性暴露于CPF后的认知改变29、30但在鱼类领域,可用的数据很少。CPF可导致斑马鱼持续的神经行为损伤,我们对早期CPF暴露后的成年斑马鱼进行了感觉运动反应(轻拍惊吓反应和习惯化)、应激反应(新型坦克潜水试验)和学习(3室坦克空间辨别)测试。研究表明,CPF可引起斑马鱼选择性的长期神经行为改变。31另一项研究发现,暴露于CPF后,斑马鱼的全脑活动显著下降。32
疼痛活动
目前关于CPF对水生物种乙酰胆碱酯酶活性的毒性报道主要集中在急性毒性,但关于该农药对水生物种乙酰胆碱酯酶活性的亚慢性毒性报道较少。CPF是众所周知的乙酰胆碱酯酶抑制剂。33大量接触有机磷农药的症状包括肌肉抽搐、多动、瘫痪、失去平衡,最终死亡34虽然低级曝光涉及各种行为和生理障碍。34乙酰胆碱酯酶(AChE)和羧酸酯酶(CbE)已被用作农药的特异性生物标志物。24,35鱼类疼痛主要是胆碱能,其活性对于正常行为和肌肉功能至关重要。36CPF的急性全身毒性是通过活性代谢物毒死蜱oxon抑制胆碱酯酶引起的,毒死蜱对未成熟动物的毒性更大,尽管它们能够迅速从胆碱酯酶抑制中恢复。毒死蜱本身,而不是人们所说的毒死蜱oxon,直接针对的是发育中的大脑所特有的事件,而不一定与胆碱酯酶抑制有关。乙酰胆碱酯酶对斑马鱼神经系统的正常发育至关重要,37因此,对CPF等乙酰胆碱酯酶抑制剂的神经兽性畸形的斑马鱼研究特别相关。CPF是鱼峡鲶鱼中疼痛活动的有效抑制剂。38在与坎亲近种暴露于致死浓度的CPF 96小时后,观察到乙酰胆碱酯酶活性受到抑制。24乙酰胆碱的抑制导致乙酰胆碱在突触连接处积聚,可能改变了暴露鱼的运动行为。乙酰胆碱酯酶活性的恢复模式与运动行为之间存在正相关。目前的研究结果清楚地表明,被试生物的运动行为在生态毒理学中是一个有前途的工具,可以评估被试生物在不良反应后的恢复状态。在一个研究中Poecila网状,鱼脑AChE呈剂量依赖性抑制。高浓度CPF对乙酰胆碱酯酶的抑制高达66%。23
同样,CbE广泛分布于生物体内,其生理作用尚不清楚,但可能与脂质代谢和甾体生成有关。39一些被发现能抑制乙酰胆碱酯酶活性的环境污染物也可能抑制CbE活性40-42结果表明,蚊鱼肌肉ChE对毒死蜱的敏感性高于脑。在对鲤鱼的研究中,CbE活性表现出剂量-反应关系,随CPF的增加而降低。CPF对鲤鱼的影响提示低剂量CPF对经过一段时间后恢复的鱼的毒性作用和高剂量CPF对不易恢复的鱼的毒性作用,但相关机制有待进一步研究。43
行为毒性
行为也被认为是生态毒理学行为的一个有前途的工具44是内源性和外源性过程的综合结果,并且在各种行为和生理障碍中涉及低水平的暴露。34在斑马鱼的研究中,观察到发育CPF暴露后持续存在的行为功能障碍。31日,26日在毒性研究中,鱼类的游泳行为经常被观察到是一种反应,因为运动活动的改变可以表明对神经系统的影响。在一项研究中Poecila试到CPF导致了积极行为的展览,水的迅速吞咽,高曲调运动和异常和畸形的游泳运动。在死亡前随着时间的时间逐渐强调鱼。它们是昏昏欲睡,并且在崩溃前在死亡时表现出瞬态过度活动。23
氧化应激
近十年来,农药诱导的氧化应激作为一种可能的毒性机制也成为毒理学研究的热点。45,46需要一个抗氧化防御系统(ADS)来保护生物分子免受活性氧(ROS)的有害影响。鱼类具有防御机制,以中和各种化学物质代谢产生的活性氧(ROS)的影响。这些包括各种抗氧化防御酶,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPOx)、谷胱甘肽S-转移酶(GST)和谷胱甘肽还原酶(GR)。据报道,低分子量抗氧化剂如谷胱甘肽(GSH)、抗坏血酸(维生素C)和维生素A也有助于氧自由基的猝灭。47没有被这种抗氧化防御系统中和的ROS会损害所有的生物分子。ROS最重要的靶点之一是膜脂过氧化(LPO)。因此,LPO估计也被成功地用于表示这些化学物质在水生动物中诱导的氧化应激。48,49.农药可能引起活性氧(ROS)的产生,从而导致氧化应激,说明ROS在农药中毒中的作用。50农药诱导的氧化应激作为一种可能的毒性机制,也是近十年来毒理学研究的热点。51,45鱼中的抗氧化剂可以用作暴露于水生污染物的生物标志物。52脂质过氧化(LPO)是农药毒性的分子机制之一。53在坎亲近种暴露于致死浓度的CPF 96 h,观察到脂质过氧化水平升高。24同一研究发现,暴露鱼中的抗氧化酶(SOD,CAT和GR)活性降低也可以有效地用于更好地评估水生环境生物的毒性毒性。治疗oreochromis niloticus毒死蜱导致GST活性增加。22对GST活性的诱导作用已在研究中观察到斑鳟属trutta后propiconazole曝光。54gst介导的偶联可能是解毒过氧化脂质分解产物的重要机制,当过氧化脂质分解产物大量出现时,会产生一些不良的生物学效应。55诱导的GST活性表明该酶在抗异虫诱导的脂质过氧化的毒性保护中的作用。GST活性升高可能反映更好地保护农药毒性的可能性。在普华宫,Poecila网状不同亚致死浓度CPF暴露96 h后,测定脑组织、肝脏和鳃组织的氧化应激诱导电位。MDA含量在所有组织中都被诱导,但在鳃中观察到最大的上升(CPF的153%)。在同一研究中,在抗氧化防御系统(ADS)中,CPF处理后的大脑和鳃中GSH水平均增加(分别为23%和21%)。与对照组相比,各处理组CAT、GST、GR和SOD水平波动较大。集体研究结果表明,鱼接触农药后,MDA和ADS随AChE活性的抑制而波动。
内分泌功能
毒死蜱可干扰类固醇激素的产生。CPF被怀疑是对鱼类生殖系统产生有害影响的触发器。在罗非鱼,oreochromis niloticus,CPF暴露降低血清雌激素和睾酮水平。雌二醇水平在暴露15天后下降60.45%,48.65%,5,0,15%,15ppb紫紫外索治疗后的56.93%。22皮质醇,一种皮质类固醇激素,被认为是所有脊椎动物稳态的重要生理学效应,通过其对代谢和免疫功能的影响。56皮质醇水平oreochromis niloticus毒死蜱处理10 PPB(59.97%)和15 PPB(39.41)均低于对照水平。22
基因毒性和致突变性
在过去,CPF的遗传毒性已经在各种试验中进行了研究,但结果是矛盾的。57岁的58由于在水生环境中存在遗传毒素的存在,因此敏感生物标志物的开发,用于检测水生生物中的遗传毒性作用。59据报道,据据报道是基因毒性鲤鱼毛虫。 60暴露于0.08 lg/l CPF引起生殖损害水蚤麦格纳。 61研究Channa punctatus.,观察到CPF由于DNA修复,CPF产生了彗星诱导形式的DNA单链中的DNA单链断裂的浓度增加,并且由于DNA修复,损伤的时间依赖性降低。62已经在暴露于不同浓度的CPF的鱼类组织中观察到DNA损伤的降低,尽管降低是非线性的,但是可能表明受损DNA的修复,受损细胞的损失,或两者。63暴露时间和DNA损伤之间的这种反比关系可能是由于污染物的毒性,这可能会在形成DNA损伤时扰乱酶促过程。64另一种可能的解释可以是在各种组织中的代谢酶如细胞色素P450的基因激活,其为持久性有机污染物提供防御机制。65
组织病理学变化
鱼肝和鳃的形态改变是有用的生物标志物,以表明在环境压力源或毒物上发生前接触。虽然肝脏是解毒的主要器官,但由于它们的亲脂性,CPF具有高鳃吸收率;这可能是这种农药暴露的鱼类敏感性的贡献因素。62异常肝细胞可干扰机体的正常代谢,从而诱发疾病甚至死亡。另一方面,鳃在鱼类的呼吸、渗透调节、酸碱平衡和含氮废物排泄方面极其重要,它们是动物与外部环境接触的第一个区域。因此,鳃的形态被认为是一种有用的环境监测指标。
在对普通鲤鱼的研究中,CPF改变了鳃和肝的结构。鲤鱼的肝脏组织揭示了不同程度的水化变性,真空溶液,脓分核,脂肪渗透,而常见的鲤鱼的鳃率呈现不同程度的上皮肥大,细胞,水肿,具有上皮分离的地下膜,一般性坏死和上皮脱落。66
结论
本文综述了CPF对鱼类影响的研究进展。所有工人都认为,这种杀虫剂在农业和家庭中的广泛使用会对鱼类等非目标生物产生不利影响。研究杀虫剂对鱼类的影响具有诊断意义,因为所得结果可用于预测人类可能的毒性机制。此外,鱼类已被证明是评估暴露于环境污染和相关生化变化的水生生态系统健康状况的有用实验模型。研究发现,急性接触CPF杀虫剂的主要毒性是胆碱能突触和神经肌肉连接处的乙酰胆碱酯酶抑制。此外,氧化应激、内分泌系统紊乱、行为、神经和发育毒性是CPF毒性在鱼类中的一些可能表现。
参考
- Rusyniak,D.E.和纳米糖,K.A.(2004)有机磷中毒。精液。神经酚。24:197-204,http://dx.doi.org/10.1055/s-2004-830907
- Venkateswara Rao,J. Parvati,K.Kavitha,P. Jakka,N.M.和Pallela,R.(2005)氯吡啶酚和千洛克洛斯对地下白蚁的运动行为和乙酰胆碱酯酶活性的影响,Odontotermes obesus.害虫。管理。Sci. 61: 417-421, http://dx.doi.org/10.1002/ps.986
- Tilak,K.S.Veeraiah,K.和Ramanakumari,G.v.(2001)氯吡啶磷毒性与淡水鱼的毒性和影响Labeo rohita(汉密尔顿)。神经科学研究20:438-445。
- Abdelhalim,K.Y.沙拉山,A.K.Elkhateeb,E.N.埃及达斯塔省的水生环境中的有机磷污染物(2006)有机磷污染物(OPP):对监测和生物标志物反应的影响。ChemoSphers 63:1491-1498,http://dx.doi.org/10.1016/j.chemophere.2005.09.019
- Arcury, T.A. Grzywacz, J.G. Barr, D.B. Tapia, J. Chen, H.和Quandt, S.A.(2007)北卡罗来纳州东部农场工人家庭儿童的农药尿液代谢物水平。环境健康透视。119:1254 - 60,http://dx.doi.org/10.1289/ehp.9975
- 瓦罗,I。塞拉诺,R。皮塔奇,E。阿马特,F。López,F.J.和Navarro,J.C.(2002)毒死蜱通过实验食物链的生物累积:蛋白质HSP70作为鱼类亚致死应激生物标记物的研究。康塔姆毒物环境拱门酒店。42:229–235, http://dx.doi.org/10.1007/s00244-001-0013-6
- 邝忠忠(2002)有机磷农药:生物化学与临床毒理学。其他。药物。24: 144-149, http://dx.doi.org/10.1097/00007691-200202000-00022
- 里士满,C.R.和Dutta,H.M。(1992)Malathion对Bluegill Sunfish脑乙酰胆碱酯酶活性的影响Lepomis macrochirus..公牛。环绕。污染。毒理学。49:431- 435,http://dx.doi.org/10.1007/BF01239648
- Dutta,H.M.Munshi,J.S.D.DUTTA,G.R.辛格,N.K.Adhikari,S.和Richmonds,C.R.(1995)年龄相关差异抑制脑乙酰胆碱酯酶活性的抑制作用Heteropneustes fossillis(布洛赫)马拉硫磷。公司。生物化学。生理学。C 111:331-334,http://dx.doi.org/10.1016/0300-9629(94)00166-Q
- 杜塔,H.M.和Arends, D.A.(2003)硫丹对蓝鳃太阳鱼幼鱼脑乙酰胆碱酯酶活性的影响。环绕。建议91:157-162,http://dx.doi.org/10.1016/S0013-9351(02)00062-2
- (2005)慢性饮食和反复急性暴露毒死蜱对大鼠学习能力和持续注意力的影响,毒死蜱科学87:460-468,http://dx.doi.org/10.1093/toxsci/kfi264
- Poet, T.S. Wu, H. Kousba, A.A. and Timchalk, C.(2003)大鼠体外肝脏和肠道代谢的有机磷农药毒死蜱和二嗪农。毒理学72:193-200,http://dx.doi.org/10.1093/toxsci/kfg035
- Mehta,A. Verma,R.S.和Srivastava,N。(2008)紫外致大鼠组织诱导的氧化DNA损伤。环境和分子诱变49:426-433,http://dx.doi.org/10.1002/em.20397
- Slotkin, T.A. Olivier, C.A.和Seidler, F.J.(2005)毒死蜱和特布他林单独或联合使用时,氧化应激在发育性神经毒性中作用的关键时期。脑研究发展157:172-180,http://dx.doi.org/10.1016/j.devbrainres.2005.04.001
- Goel,A. Danni,V.和Dhawan,D.K.(2005)锌对脂质过氧化抗氧化酶和肝组织建筑在紫外毒性毒性中的保护作用。Chemico-Biological互动156:131-140,http://dx.doi.org/10.1016/j.cbi.2005.08.004
- 使用PA(2011A)。氯吡啶:注册审查的初步人体健康风险评估。DP编号D388070。
- 构成(2011 b)。修订毒死蜱初步注册审查饮用水评估。DP没有。D368388, 389480年。
- Chen,C.Li,Y.陈,M.陈,Z.和Qian,Y。(2009)有机磷农药残留在碾米中(奥雅萨苜蓿)和膳食风险评估。食品添加污染部分A化学肛门控制博览会风险评估26:340-7,http://dx.doi.org/10.1080/02652030802524516
- 太阳,F.和Chen,H.S.(2008)养殖农药紫外线残留物的监测!SH:对可能的来源调查。ChemoSphere.71:1866-9,http://dx.doi.org/10.1016/j.chemophere.2008.01.034
- 詹图宁,A.P.图伊卡,A。阿克卡宁,J。和Kukkonen,J.V.(2008)阿特拉津和毒死蜱对环境的生物累积Lumbriculus variegatus从湖泊沉积物。Ecotoxicol Environ Saf. 71: 860-8, http://dx.doi.org/10.1016/j.ecoenv.2008.01.025
- Barron,M.G.和伍德本,K.B.(1995)。氯吡啶的生态毒理学。Rev. Environ。contam.toxicol。144:1-93,http://dx.doi.org/10.1007/978-1-4612-2550-8_1
- Oruç,E.O.(2010)研究对象的氧化应激、类固醇激素浓度和乙酰胆碱酯酶活性oreochromis niloticus暴露于氯吡啶。农药生物化学与生理学96:160-166,http://dx.doi.org/10.1016/j.pestbp2009.11.005
- Sharbidre,A.A.Metkari,v。和模子,P。(2011)甲基硫磷和紫紫外索对普遍鱼类各种组织中某些生物标志物的影响,Poecilia网格网.农药生物生理10:132-141,http://dx.doi.org/10.1016/j.pestbp.2011.09.002
- Kavithaa, P.和Venkateswara Rao, J.(2008)。毒死蜱对蚊鱼抗氧化酶和靶酶乙酰胆碱酯酶相互作用的毒性效应,坎亲近种.环绕。Toxicol。Pharmacol. 26: 192-198, http://dx.doi.org/10.1016/j.etap.2008.03.010
- 兴,H. Wang,X. Sun,G. Gao,X. Xu,S.和Wang,X.(2011)尿嘧啶和紫外线对普通鲤鱼谷胱甘肽S-转移酶活性和转录的影响(Cyprinus carpioL.)。环绕。Toxicol。药学。33:233-244,http://dx.doi.org/10.1016/j.etap.2011.12.014
- 莱文,E.D.Swain,H.a.Donerly,S.和Linney,E。(2004)发育紫杉虾对孵化斑马鱼游泳行为的影响。神经毒性和畸形学26:719-723,http://dx.doi.org/10.1016/j.ntt.2004.06.013
- Levin, E. crythansis, E. Yacisin, K.和Linney, E.(2003)毒死蜱暴露对发育中的斑马鱼的生存影响和对反应潜伏期和空间辨别的长期影响。神经毒理学与畸形学25:51 - 57,http://dx.doi.org/10.1016/S0892-0362(02)00322-7
- Richendrfer, H. Pelkowski, S.D. Colwill, R.M.和Créton, R.(2012)对毒死蜱的亚慢性发育暴露降低了斑马鱼幼体的焦虑相关行为。神经毒理学与畸形学34:458-465,http://dx.doi.org/10.1016/j.ntt.2012.04.010
- Braquenier,J.B.Quertemont,E.Tirelli,E.和Plumier,J.C.(2010)在围产期暴露于氯吡啶之后成年女性小鼠的焦虑。神经毒毒素特拉醇。32:234-9,http://dx.doi.org/10.1016/j.ntt.2009.08.008
- (2010)反复接触低水平毒死蜱会导致大鼠持续注意力受损和冲动增加。Neurotoxicol Teratol 32: 415-24, http://dx.doi.org/10.1016/j.ntt.2010.03.008
- Sledge, D. Yen, J. Morton, T. Dishaw, L. Petro, A. Donerly, S. Linney, E. and Levin, E.D.(2011)毒死蜱诱发的发育性神经行为毒性暴露的临界时间。神经毒理学与畸形学33:742-751,http://dx.doi.org/10.1016/j.ntt.2011.06.005
- Eddins,D. Cerutti,D. Williams,P. Linney,E.和Levin,E.D。(2010)发育氯吡啶肌导致斑马鱼中的行为和神经化学缺陷。神经毒毒素特拉醇。32:99-108,http://dx.doi.org/10.1016/j.ntt.2009.02.005
- 泰勒,B.和布朗,J.H.(1999)。乙酰胆碱。见:Siegel, g.j., Agranoff, b.w., Albers, r.w., Fisher, s.k., Uhler, M.D. (Eds.),基础神经化学:分子,细胞和医学方面。LippincottRaven,费城,宾夕法尼亚州,213-242页。
- Sandahl, J.F. Baldwin, D.H. Jenkins, J.J. and Scholz, N.L.(2005)。毒死蜱暴露下银鲑乙酰胆碱酯酶抑制和行为障碍的比较阈值。环绕。Toxicol。化学,24:136-145,http://dx.doi.org/10.1897/04-195R.1
- Leticia, A.G.和Derardo, G.B.(2008)。礁鱼中酯酶活性的测定及胆碱酯酶的特性Haemulon Plumieri..Ecotoxicol。环绕。Saf. 71: 787-797, http://dx.doi.org/10.1016/j.ecoenv.2008.01.024
- (2000)比目鱼胆碱酯酶活性的研究(Platichthys flesus)肌肉组织作为英国河口中神经毒性污染的生物标志物。Mar. Pollut。公牛。40:780-791,http://dx.doi.org/10.1016/s0025-326x(00)00069-2
- Behra,M. Cousin,X. Bertrand,C.Vonesch,J.Biellmann,D。Chatonnet,A.和Strahle,U.(2002)乙酰胆碱酯酶在斑马鱼胚胎中的神经元和肌肉发育需要,自然神经科学5:111- 118,http://dx.doi.org/10.1038/nn788
- 斯特鲁斯,D.L.并通过紫外波,离散和S,S,S,stibutyl磷硫锂(Def)抑制鱼乙酰胆碱酯酶和鱼氨酸鲶鱼的乙酰胆碱酯酶和Aliesterase的抑制。Aquat。Toxicol。33:311-324,http://dx.doi.org/10.1016/0166-445x(95)00024-x
- 李M.H.(2008)。壬基酚对雄孔雀鱼胆碱酯酶和羧酸酯酶活性的影响(poecilia teticulata.)。Ecotoxicol。环绕。SAF。71:781-786,http://dx.doi.org/10.1016/j.ecoenv.2008.02.014
- Küster, E.(2005)斑马鱼胚胎发育中的胆碱和羧酸酯酶活性(鲐鱼类)及其对杀虫剂危害评估的潜在用途。Aquat。Toxicol。75:76-85,http://dx.doi.org/10.1016/j.aquatox2005.07.005
- Boone,J.S.和室,J.E.(1997)在蚊虫中含有毒死蜱,脱硫和甲基脱硫之间有助于毒性差异的生物化学因素(坎亲近种). 阿奎特。毒物。39: 333, http://dx.doi.org/10.1016/S0166-445X(97)00019-2
- Carr,R.L.Ho,L.L.和Chambers,J.E.(1997)在环境暴露期间对几种鱼的紫外线选择性毒性:生化机制。环绕。Toxicol。化学。16:2369,http://dx.doi.org/10.1002/etc.5620161124
- 邢,H。王,J。李,J。范,Z。王,M。徐,S(2010)阿特拉津和毒死蜱对鲤鱼脑和肌肉中乙酰胆碱酯酶和羧酸酯酶的影响。环境毒理学和药理学30:26-30,http://dx.doi.org/10.1016/j.etap.2010.03.009
- Cohn,J.和Macphail,R.C.(1997)紫外线在重复收购和表现的时间表下工作的大鼠中的选择性学习措施。J pharmacol exp ther。283:312-20。
- Abdollahi, M. Ranjbar, A. Shadnia, S. Nikfar, S. and Rezaie, O.E.(2004)农药与氧化应激:综述。医学监测10:141 - 147。
- 沙尔马,Y. Bashir, S. Irshad, M. Gupta, S.D.和Dogra, T.D.(2005)急性乐果给药对实验性大鼠肝和脑抗氧化状态的影响,毒理学206:49-57,http://dx.doi.org/10.1016/j.tox.2004.06.062
- Orbea, A. Ortiz Zarragoitia, M. Sole, M. Porte, C. and Cajaraville, M.P. (2002) Urdaibai和Plentzia河口(比斯开湾)双壳类软体动物、螃蟹和鱼类中抗氧化酶和过氧化物酶体增殖与多环芳烃和多氯联苯污染体负担的关系。Aquat。毒理学。58:75-98,http://dx.doi.org/10.1016/S0166-445X(01)00226-0
- Favari, L. Lopez, E. Martinez-Tabche, L.和Diaz-Pardo, E.(2002)杀虫剂对伊格纳西奥·拉米雷斯水库(墨西哥)浮游生物和鱼类的影响:一项生化和生物放大研究。生态毒理学与环境安全51:177-186,http://dx.doi.org/10.1006/eesa.2002.2142
- Monserrat,J.M.Geracitano,L.A.Pinho,G.L.L.Vinagre,下午Falerios, M. Alciati, J.C.and Bianchini, A. (2003)Determination of lipid peroxides in invertebrates tissues using the Fe(III) xylenol orange complex formation, Archives of Environmental Contamination and Toxicology 45: 177–183, http://dx.doi.org/10.1007/s00244-003-0073-x
- Sayeed, I. Parvez, S. Pandey, S. BinHafeez, B. Haque, R. and Raisuddin, S.(2003)淡水鱼暴露于溴氰菊酯的氧化应激生物标志物Channa punctatus.布洛赫。Ecotoxicol。环绕。Saf. 56: 295-301, http://dx.doi.org/10.1016/S0147-6513(03)00009-5
- Akhgari,M. Abdollahi,M.Kebryaeezadeh,A.Hosseini,R.和Sabzevari,O.(2003)自由杀菌脂质过氧化的生物化学证据作为血液和肝脏血液和肝脏血管毒性的副毒性的机制。哼。Exp。Toxicol。22:205-211,http://dx.doi.org/10.1191/0960327103ht3460a
- Ahmad,I. Hamid,T. Fatima,M. Chand,H.S.jain,s.k.athar,m。和raisuddin,s。(2000)。淡水鲶中肝抗氧化剂的诱导(Channa punctatus.Bloch)是造纸厂废水暴露的生物标志物。他。生物物理。Acta 1523:37-48。
- Kehrer,摩根大通(J.P.(1993)。自由基作为组织损伤和疾病的介质。暴击。Rev. Toxicol. 23: 21-48, http://dx.doi.org/10.3109/10408449309104073
- EAGAAS,E. Sandvik,M. Fleld,E. Kallqvist,T.Goksoyr,A.和Svensen,A.(1999)杀真菌丙酸对细胞色素P450和棕色鳟鱼谷胱甘肽S转移酶的一些影响(斑鳟属特鲁塔)。Comp。生物学习。physiol。122:337-344。
- Leaver, M.J.和George, S.G.(1998)一种有效结合脂质过氧化最终产物的piscidine谷胱甘肽s -转移酶,3 . Environ。议题46:71-74,http://dx.doi.org/10.1016/S0141-1136(97)00071-8
- Hontela, A. Daniel, C.和Rasmussen, J.B.(1997)魁北克圣莫里斯河暴露于漂白牛皮厂废水的鱼的下丘脑-垂体-肾间轴的结构和功能损害。生态毒理学6:1 - 12,http://dx.doi.org/10.1023/A:1018699405158
- 帕特奈克,K。Tripathy,N.K.(1992)农场级氯代吡啶(Dermot)对果蝇的体细胞和生殖系细胞具有遗传毒性。变异。第279号决议:15-20,http://dx.doi.org/10.1016/0165-1218(92)90261-W
- Gollapudi, B.B. Mendrala, A.L.和Linscombe, V.A.(1995)有机磷杀虫剂氯吡fos的遗传毒性评价。Mutat。Res. 342: 25-36, http://dx.doi.org/10.1016/0165-1218(95)90087-X
- Hayashi,M. Ueda,T. Uyeno,L. Wada,K.Kinae,N. Saotome,K.Tanaka,N. Takai,A. Sasaki,Y.F.Asano,N. Sifuni,Y。和Ojimma,T.(1998)的发展使用水生生物的遗传毒性测定系统。Mutat。res。399:125-133,http://dx.doi.org/10.1016/s0027-5107(97)00251-0
- P.K.和Prasad, R.(1998)毒死蜱的基因毒性效应Channa.粉虱.细胞前体。吉内特。9: 631–638.
- 环境保护局(1985年)。纪律审查生态影响概况。可从美国环境部获得。保护局,农药项目办公室,401 M St.S.W.,华盛顿特区20460,10p。
- Ali,D. nagpure,N.S.Kumar,S. Kumar,R.Kushwaha,B.和Lakra,W.S.(2009)评估淡水鱼中氯吡啶的遗传毒性和致突变作用Channa punctatus.(Bloch)采用微核分析和碱性单细胞凝胶电泳。食品化学。毒理学。47:650-656,http://dx.doi.org/10.1016/j.fct.2008.12.021
- 巴努,B.S.达纳德维,K。Rahman,M.F.Ahuja,Y.R.和Kaiser,J(2001)使用彗星试验研究久效磷对哨兵物种的遗传毒性效应。食品化学。毒物。39: 361–366, http://dx.doi.org/10.1016/S0278-6915(00)00141-1
- Rank,J。詹森,K(2003)蓝贻贝鳃和血细胞彗星试验。生态毒性。包围苏丹武装部队。54: 323–329, http://dx.doi.org/10.1016/S0147-6513(02)00006-4
- 黄志强、杨志强、胡宏英、P.S.及黄m.h.(2001)罗非鱼鳃、肠及肝脏细胞色素P4501A1基因的特异性表达。水生毒物54:69-80,http://dx.doi.org/10.1016/S0166-445X(00)00173-9
- 邢,H.Li,S. Wang,S.Gao,X. X. Xu,S.和Wang,X.(2012)普通鲤鱼中唑唑和紫外线暴露导致的氧化应激反应和组织病理学变化。农药生物化学与生理学103:74-80,http://dx.doi.org/10.1016/j.pestbp.2012.03.007

这个作品是根据知识共享署名4.0国际许可.








